Page 1 sur 1
Camomille bleue
Publié : 29/08/2015, 18:52
par brusicor02
Bonjour,
J'ai passé 6 mois dans le service R&D d'une entreprise de fabrication de matières premières aromatiques, j'ai donc vu de nombreux échantillons d'huiles essentielles et d'extraits de plantes passer. Il y en a une plante que j'aime particulièrement et qui m'intrigue, c'est la camomille bleue (
Matricaria chamomilla). Voilà un échantillon de l'huile essentielle diluée à 10% dans l'éthanol :

Un joli bleu assez inhabituel alors que les huiles essentielles souvent entre l'incolore et le jaune-orangé. Bon, on trouve aussi du vert (huile essentielle de lie de vin) ou d'autres excentricités.
L'origine de la couleur bleue est due au charmazulène :

7-éthyl-1,4-diméthylazulène
Comme la camomille bleue n'est pas de couleur bleue initialement, c'est donc un artefact produit lors de la distillation pour recueillir l'huile essentielle. C'est un composé nommé "matricine" qui va par hydrolyse et décarboxylation donner notre composé bleu$^{\left [ 1 \right ]}$ :

Décomposition de la matricine pour former du charmazulène
Se dire qu'un simple hydrocarbure puisse être bleu me fascine : alors qu'il possède le même nombre d'électrons $\pi$, l'azulène est bleu alors que le naphtalène est incolore$^{\left [ 2 \right ]}$. Et, si on s'amuse à le dériver, on peut obtenir des composés qui vont peuvent être de couleur verte voire magenta$^{\left [ 3 \right ]}$ !
J'ai récupéré lors de mon stage quelques échantillons d'huile essentielle de camomille bleue, je vais voir si mon professeur est partant pour des petites expériences dessus (séparation chromatographique, dérivation, spectre UV-visible et tout le barda).
 Bibliographie
Bibliographie :
$\left [ 1 \right ]$ N.J. Walton et D.E. Brown,
Chemicals from Plants: Perspectives on Plant Secondary Products,
1999, Word Scientific, p 172
$\left [ 2 \right ]$ D.M. Lemal et G.D. Goldman, "Synthesis of azulene, a blue hydrocarbon",
J. Chem. Educ.,
1988, 65 (10), p 923
$\left [ 3 \right ]$ R.S.H. Liu, "Colorful Azulene and Its Equally Colorful Derivatives",
J. Chem. Educ.,
2002, 79 (2), p 183
Re: Camomille bleue
Publié : 29/08/2015, 19:59
par darrigan
Très intéressant !
On pourrait même tenter une modélisation (chimie quantique) pour optimiser et calculer les propriétés spectrales du charmazulène. Bon à mon avis, ce doit être très proche de l'azulène, car les groupes méthyles et l'éthyle ne doivent pas changer grand chose.
Ton expérience me fait penser aussi au pastel,
Isatis tinctoria, qui n'est pas bleu du tout, mais qui permet d'obtenir l'indigo, par oxydation à l'air ambiant.
Tiens ça te dirait pas de faire une petit page sur le wiki avec ton expérience, si c'est une plante facile à obtenir ?

Re: Camomille bleue
Publié : 29/08/2015, 23:18
par ecolami
Bonsoir,
La Camomille est aussi utilisée dans les shampooings pour une action éclaircissante douce. Je n'ai jamais su l'expliquer. Pourtant sur internet on trouve plein de recettes sans aucune explication.
Re: Camomille bleue
Publié : 30/08/2015, 01:53
par brusicor02
Après, il y a différentes camomilles sur le marché : la camomille romaine (Chamaemelum nobile), la camomille bleue (Matricaria recutita), la grande camomille (Tanacetum parthenium)... La matricine est présente chez Matricaria recutita et Tanacetum parthenium, mais moins chez Chamaemelum nobile qui donne une huile essentielle jaune.
L'huile essentielle de camomille bleue coûte quelque chose comme 1300€/L... Le charmazulène constitue environ 5% en masse de l'huile, donc
Mais peut-être qu'en pratiquant la distillation soi-même avec des plantes, on peut arriver à quelque chose d'intéressant : c'est par entrainement à la vapeur, mais il semble qu'il y ait quelques spécificités. Je vais faire un peu de biblio dessus lundi.
Pour les applications pour l'éclaircissement des cheveux, il s'agit de la camomille romaine. Mais j'ai rien trouvé encore sur les origines du phénomène.
Re: Camomille bleue
Publié : 30/08/2015, 12:12
par Maurice
Cette histoire de couleur bleue de l'azulène me titille quelque peu. Cela veut dire que l'azulène et ses dérivés alkylés, absorbe dans le rouge et l'orangé. Et cela n'est pas le cas pour le naphtalène qui a pourtant le même nombre d'électrons pi. Cela a sûrement un rapport avec la géométrie des cycles conjugués à 5 et 7 atomes C, et les déterminants de Hückel. Comment est-ce qu'on explique cette absorption ? Je pourrais bien sûr farfouiller dans la littérature pour trouver la réponse à cette question. Mais je suis un peu paresseux, et je me dis que c'est peut-être très simple, et que quelqu'un du forum a déjà la réponse. Est-ce le cas ?
Re: Camomille bleue
Publié : 30/08/2015, 14:58
par brusicor02
Cela vient du fait que le naphtalène est un aromatique alternant et l'azulène un aromatique non alternant.

Je développe : on marque avec une étoile un carbone conjugué sur deux. On constate que, pour le naphtalène (à gauche), un atome marqué est entouré uniquement de carbones non marqués et vice-versa. Alors que, pour l'azulène, on a deux atomes marqués qui sont liés par une liaison (en rouge).

Le naphtalène est donc un aromatique alternant, une classe qui a des propriétés très intéressante parce qu'on peut simplifier les calculs des déterminants de la méthode d'Hückel. On a même le théorème suivant :
théorème d'appariement :
Dans un hydrocarbure alternant, les niveaux d'énergie sont disposés symétriquement par rapport à un niveau d'énergie $\alpha$.
Ainsi, à une orbitale $\Psi_p$ d'énergie $E_p=\alpha + x_p \, \beta$ correspond une autre orbitale $\Psi_{-p}$ d'énergie $E_{-p}=\alpha - x_p \, \beta$.
Si on compare $\Psi_p$ et $\Psi_{-p}$, les coefficients des carbones marqués sont égaux et ceux des carbones non marqués sont opposés.
Donc si on récapitule : notre naphtalène a 10 orbitales $\pi$ impliquées dans le recouvrement, donc 10 orbitales moléculaires à construire : on va trouver que la HOMO va être en couple avec la LUMO. La densité électronique ne va pas beaucoup changer entre les deux, puisqu'on a les mêmes coefficients au signe près. Pour l'azulène, c'est un aromatique non alternant : il va donc avoir une répartition non uniforme et ainsi avoir un moment dipolaire, et les coefficients entre la HOMO et la LUMO ne sont pas les mêmes.
Maintenant, considérons ce qui se passe lors de l'absorption du photon : un électron passe de la HOMO à la LUMO : $$\begin{bmatrix}
\text{LUMO} & \\
\text{HOMO} & \uparrow \downarrow
\end{bmatrix} \; \xrightarrow[]{\text{absoption du photon}} \; \begin{bmatrix}
\text{LUMO}^\ast & \; \; \downarrow \\
\text{HOMO}^\ast & \uparrow \; \;
\end{bmatrix}$$Dans le cas du naphtalène, LUMO et HOMO sont centrées sur les mêmes atomes avec des probabilités identiques : la répulsion électronique entre les deux électrons augmentent puisqu'on passe d'une paire à deux célibataires localisés aux mêmes endroits. Dans le cas de l'azulène, les orbitales frontières sont localisées sur des atomes différents, ça diminue la répulsion et donc augmente le gain du transfert.
J'ai essayé d'expliquer cela avec les mains, mais c'est assez compliqué.

Re: Camomille bleue
Publié : 30/08/2015, 15:40
par Maurice
Merci RuBisCo de la peine que tu te donnes pour expliquer les différences entre le naphtalène et l'azulène. Mais moi, ce qui 'intéresse c'est la différence entre la longueur d'onde de l'absorption du naphtalène et celle de l'azulène.
Dans le naphtalène, il y a 5 niveaux d'énergie remplis par deux électrons, et tous liants. Il me semble que la HMO est dégénérée deux fois, et située à un niveau de α + β, et la LUMO est aussi dégénéré deux fois mais située à α - β. Il y a peut-être un coefficient numérique devant β. Mais cela ne change pas beaucoup le raisonnement. Est-ce que ce que je dis est correct ? Si oui, la transition HOMO - LUMO correspond à un saut en énergie de 2 β, qui est finalement assez élevé.
Comment se placent les niveaux d'énergie dans l'azulène ? Intuitivement, on sent qu'il n'y a probablement plus de dégénérescence, donc que le passage HOMO - LUMO est plus petit. Est-ce vraiment le cas ?
Re: Camomille bleue
Publié : 30/08/2015, 18:42
par darrigan
Si RuBisCO ne trouve pas de diagramme d'OM, je pourrais lancer un calcul.
En attendant, voilà un champignon qui tire sa couleur bleue d'un autre dérivé :
https://en.m.wikipedia.org/wiki/Lactarius_indigo
Et je sais qu'il existe un autre champignon à chair claire qui vire au bleu quand on le coupe en morceaux, probablement une oxydation.... Serait-ce encore un dérivé d'azulène ? Tout cela titille la curiosité

Re: Camomille bleue
Publié : 30/08/2015, 19:25
par brusicor02
Dans la source $\left [ 2 \right ]$, on a le diagramme des OM des deux molécules (cliquez pour agrandir) :
 $\; \; \; \; \;$
$\; \; \; \; \;$ 
Schéma des orbitales moléculaires frontières pour l'azulène (à gauche) et du naphtalène (à droite).
On constate très bien les coefficients qui changent de signes pour le naphtalène.
Re: Camomille bleue
Publié : 30/08/2015, 21:06
par Maurice
Merci RubisCo. C'est tout ce que je voulais savoir dans le naphtalène, la transition HOMO-LUMO demande 0.9 bêta, ce qui est dans le visible, alors que dans le naphtalène, il en faut 1,2. Cela suffit pour passer dans l'ultra-violet. Merci !
P.S. Comment fait-on pour insérer une lettre grecque dans le Forum ?
Re: Camomille bleue
Publié : 31/08/2015, 00:02
par brusicor02
Il te faudra utiliser le $\LaTeX$ pour ça : \beta donnera $\beta$ et \Psi donnera $\Psi$.
Re: Camomille bleue
Publié : 31/08/2015, 17:58
par darrigan
Voilà un petit calcul DFT que je viens de faire (je passe sur les détails

) et les énergies des OM (en unités atomiques), et les dessins des LUMO, HOMO et HOMO-1.
C'est bien semblable aux dessins récupérés par RuBisCo.
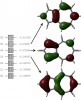
- Azulène OM
Le moment dipolaire calculé est de 1,26 D.
Spectre d'absorption calculé en TD-DFT :

- Azulène UV-visible
Attention c'est un calcul quantique où la molécule est
isolée, donc pas d'effet de solvant. Pour bien faire il faudrait ajouter un solvant, car l'absorption peut en dépendre fortement.
Re: Camomille bleue
Publié : 31/08/2015, 18:52
par brusicor02
Intéressant Darrigan. Je veux bien les détails moi.

Cela n'a pas l'air d'être les résultats de Gaussian.









