Mais dans le corrigé de mon prof,je me suis rendu compte que je ne sais pas comment placer les doublets du ligand.
voici le corrigé de mon prof :
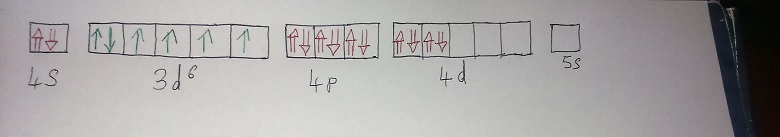
Fe2+:1s2.2s2.2p6.3s2.3p6.4s0.3d6.(là j'ai compris,c'est pour une question de stabilité).
L'espèce est paramagnétique d'après l'énoncé.
J'ai aussi compris comment on remplit les cases quantiques en générales et je sais qu'on a 6 doublets de ligands car on a "F6".
Cependant je ne comprend pas comment on place les doublets du ligand(en rouge sur mon image) dans les cases quantiques.
En effet je vois qu'il y a des doublets du ligand dans la 4s alors qu'on a 4s0 .
Ensuite on remplit la 4d avant la 5s,mais on dessine quand même la 5s alors qu'elle est vide.
Enfin dans cet exo les doublets du ligand sont en majorité après la 3d,mais dans d'autres cas vu en cours,j'ai vu des doublets du ligand dans la 3d...
Pouvez -vous me dire comment on place ces doublets s'il vous plait ?