Page 1 sur 1
Orbitales atomiques et la géométrie
Publié : 05/11/2021, 21:32
par Momo
Bonjour, j’aimerai savoir comment à partir de l’hybridation d’une molécule on peut remonter à sa formule géométrique. Je dis ça car je ne comprend pas la forme tridimensionnelle des allènes. Pourquoi certaines liaisons restent sur le même plan et d’autres ne le sont pas. Ex (C3H4)
Re: Orbitales atomiques et la géométrie
Publié : 06/11/2021, 17:24
par Maurice
D'habitude, on procède en sens inverse. On commence par définir la géométrie d'une molécule. On cherche ensuite la nature de l'hybridation qu'il faut envisager pour expliquer la forme de la molécule.
Re: Orbitales atomiques et la géométrie
Publié : 06/11/2021, 20:21
par darrigan
Dans l'allène, H
2C=C=CH
2, les deux carbones aux extrémités sont hybridés sp
2 (géométrie trigonale), et le carbone central est hybridé sp (géométrie linéaire). Les orbitales π de part et d'autre du carbone central (en rouge et en bleu sur le dessin) sont dans des plans perpendiculaires. Ainsi, les 2 H d'un côté dans un plan perpendiculaire aux 2 H de l'autre côté.
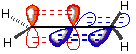
- allene.gif (1.01 Kio) Consulté 4253 fois
Re: Orbitales atomiques et la géométrie
Publié : 07/11/2021, 10:44
par Maurice
Darrigan a raison. Mais ce raisonnement est basé sur la logique que j'ai expliqué précédemment. On a d'abord montré expérimentalement que les deux groupes CH2 terminaux de l'allène ne sont pas coplanaires. Et on a ensuite développé un schéma explicatif montrant que les deux liaisons pi ne sont pas non plus coplanaires, et sont donc dans des plans perpendiculaires l'un à l'autre. Si l'expérience avait montré que les deux groupes CH2 terminaux avaient été trouvés coplanaires, on aurait alors modifié notre interprétation théorique, et on aurait modifié la théorie de manière à obtenir des liaisons pi coplanaires.